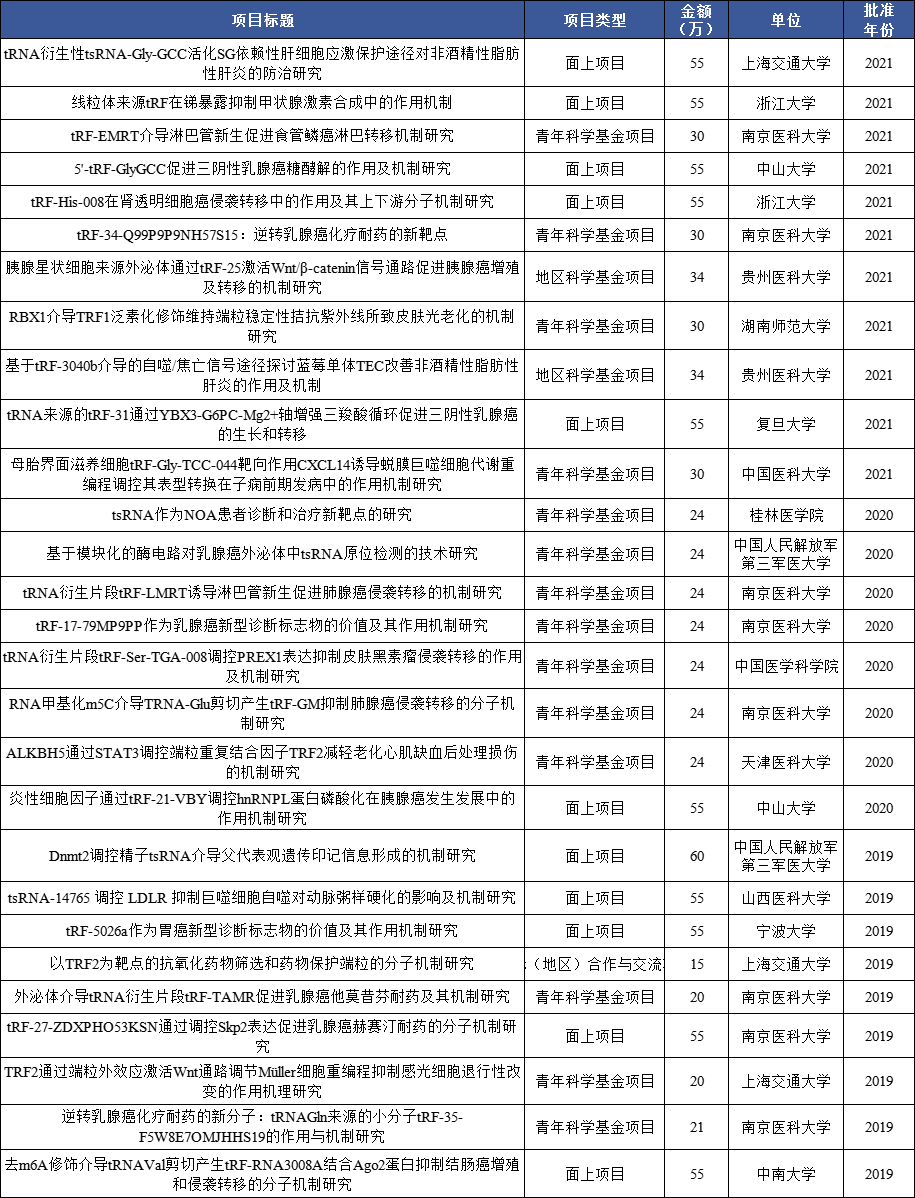
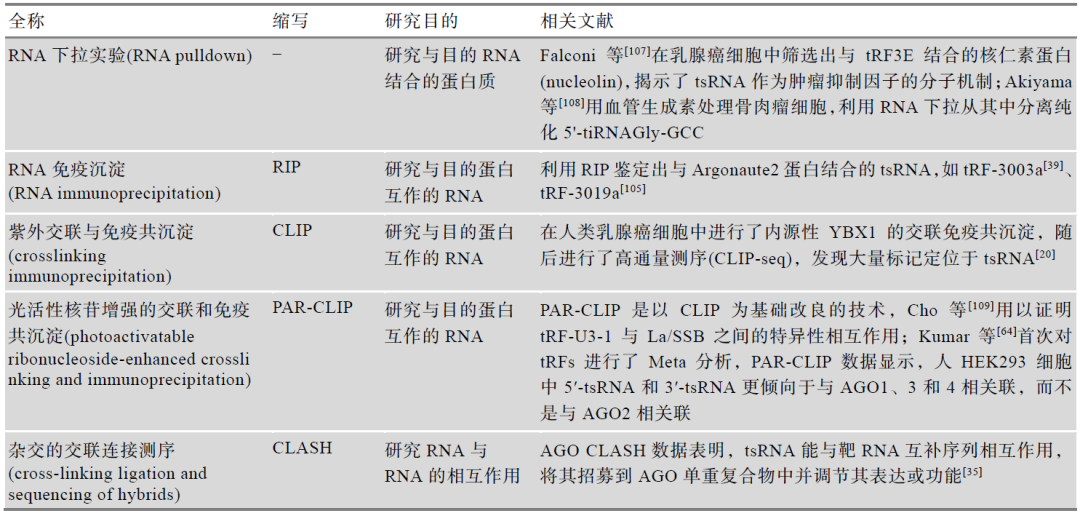
潘多拉测序与非编码小RNA标志物开发研究方案:液体活检新星—tsRNA、rsRNA、piRNA
知识卡片:tsRNA的生物学功能
1. 调节mRNA 稳定性:tsRNA 具有microRNA 类似的作用,通过靶向mRNA调节其稳定性;
2. 调控蛋白质的翻译
(1)通过影响核糖体的生物发生增强翻译: 在小鼠和人类的研究中已证实tsRNALeuCAG可以结合核糖体蛋白RPS28 的mRNA 增强其翻译;
(2)通过与核糖体结合抑制翻译:tsRNA 能与核糖体成分(小亚基16S rRNA)结合,使翻译整体抑制;
(3)调控翻译起始过程:tsRNA能够形成分子间RNA G 四聚体(RG4)来代替翻译起始因子eIF4 复合物,抑制翻译;RG4 结构还能与YB-1 结合,抑制翻译起始复合物形成;
3. 作为表观遗传调控因子:tsRNA 可以影响不同的表观遗传过程来调节基因的表达,比如可以与PIWI 蛋白相互作用,促进H3K9 甲基化;
4. 调控转座子:HeLa细胞18-nt-3' tsRNA 与成熟tRNA竞争性地结合到反转录转座子的引物结合位点,阻断其逆转录。

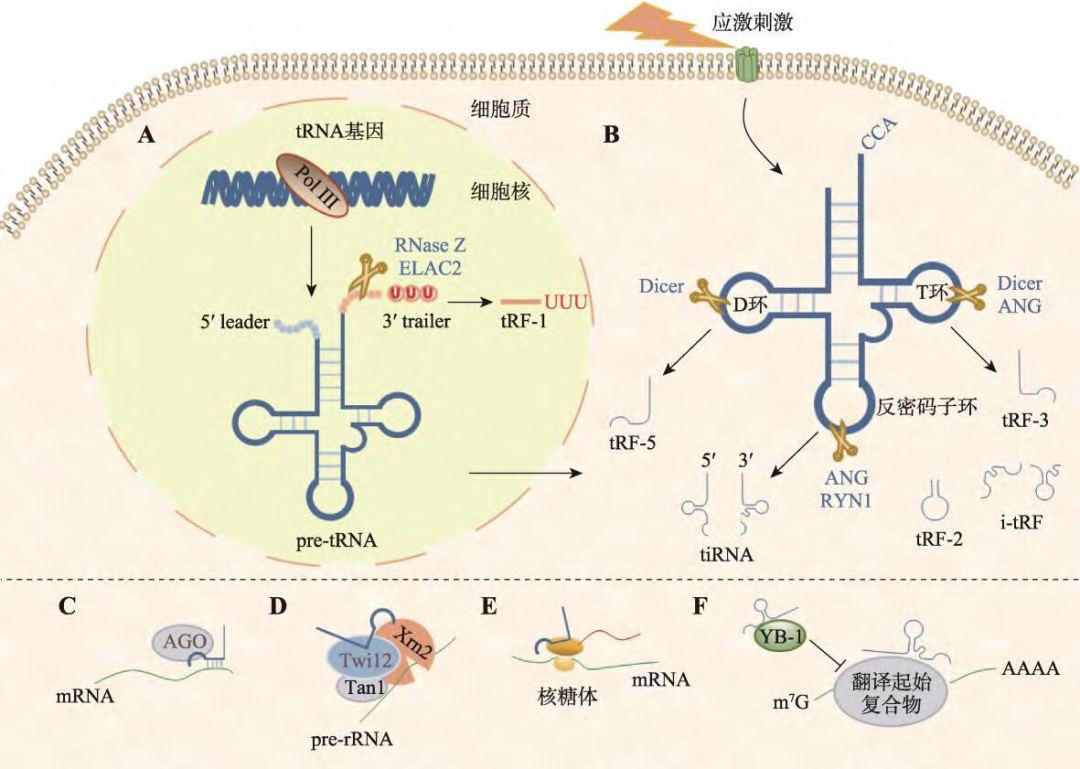
图1. tsRNA 分类与作用机制[1]
A:tRNA 前体由RNase Z 或ELAC2 剪切3'端形成tRF-1;B:Dicer 酶剪切D 环生成tRF-5,ANG 或Dicer 酶剪切T 环生成tRF-3,RYN1 或ANG 剪切反密码子环生成tiRNA,tRF-2 和i-tRF 对应中间序列;C:结合AGO 蛋白抑制mRNA 翻译;D:调控rRNA 的形成;E:竞争性结合核糖体;F:调控翻译起始。
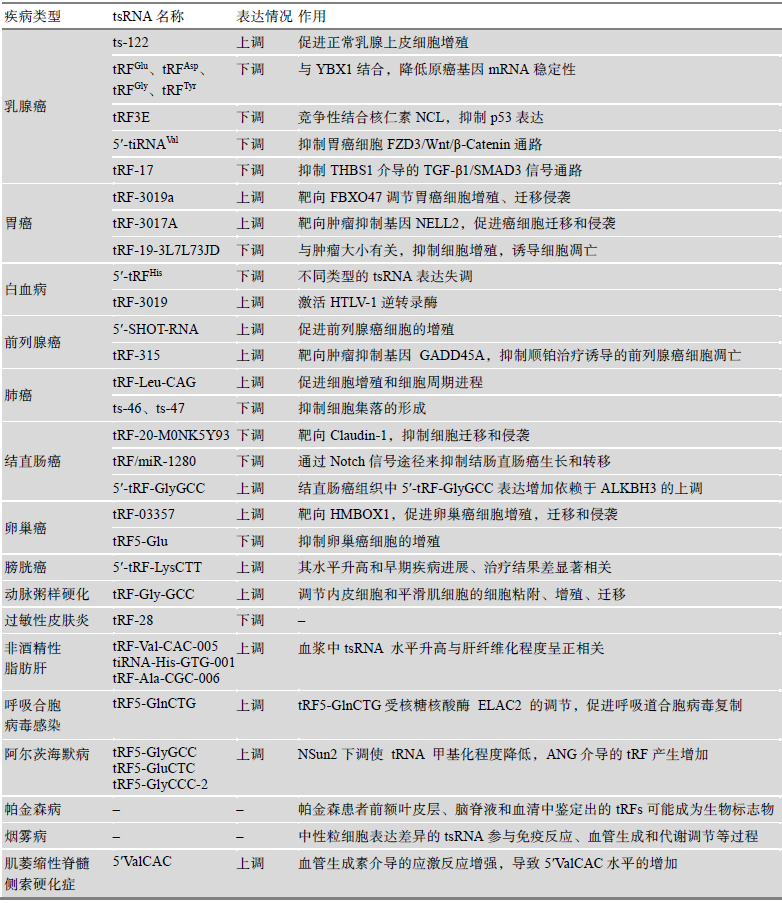
知识卡片:tsRNA与疾病标志物
1. 病毒感染:在HBV或HCB病毒感染的组织细胞中,tsRNA 的丰度发生明显改变;
2. 应激:外周循环中的tsRNA对急性炎症、衰老、能量限制、急性肾脏疾病和组织损伤等具有敏感性, 可能是一类有用的非侵入性生物性标志物;
3. 肿瘤:已有研究表明tsRNA在多种癌症中被异常调节,这些发生异常调节的tsRNA可能是疾病诊断、靶向治疗和预后等的生物标志物。

(点击放大)
(点击放大看原图)
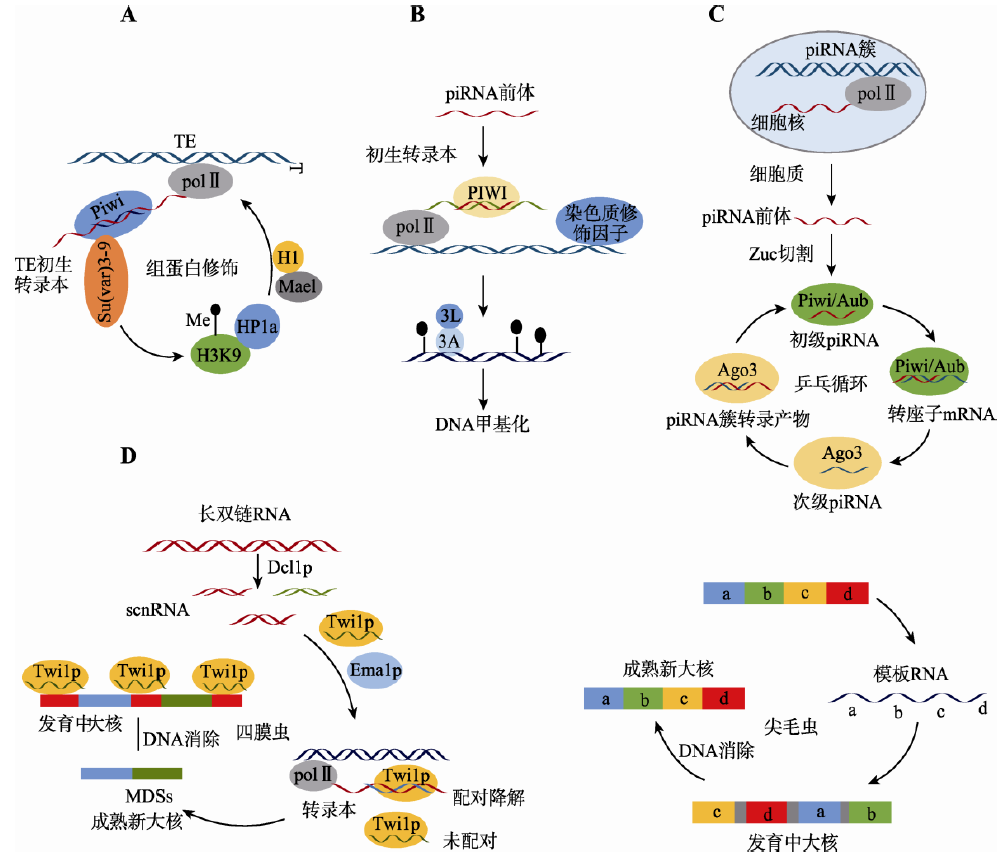
图2. piRNA 抑制基因转座的途径[2]
A:组蛋白修饰途径。piRNA 能引起组蛋白修饰,导致染色质紧缩,从而抑制转座子转座;B:DNA 甲基化途径。piRNA 能引起H3K9甲基化和H3K4 去甲基化,随后招募DNA 甲基化转移酶,引起LINE-1 DNA 的甲基化而抑制LINE-1 的转录;C:乒乓循环途径。次级piRNA 扩增的同时,转座子mRNA 作为底物被大量消耗,导致转座被抑制;D:DNA 消除途径。四膜虫接合期间,在母体小核中产生的scnRNA 与Twi1p 复合体能介导収育中的大核IESs 区域的整体删除;尖毛虫接合期间,母本大核中形成的模板RNA 迚入収育中的大核,作为模板指导IESs 删除和乱序的MDSs 重新排序。两种方式都能删除转座子基因序列,导致转座被抑制。
表3. PIWI在多种癌症类型中的表达[3]
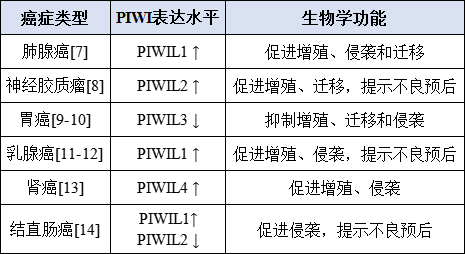
表4. FDA近年许可和批准的实体肿瘤液体活检项目
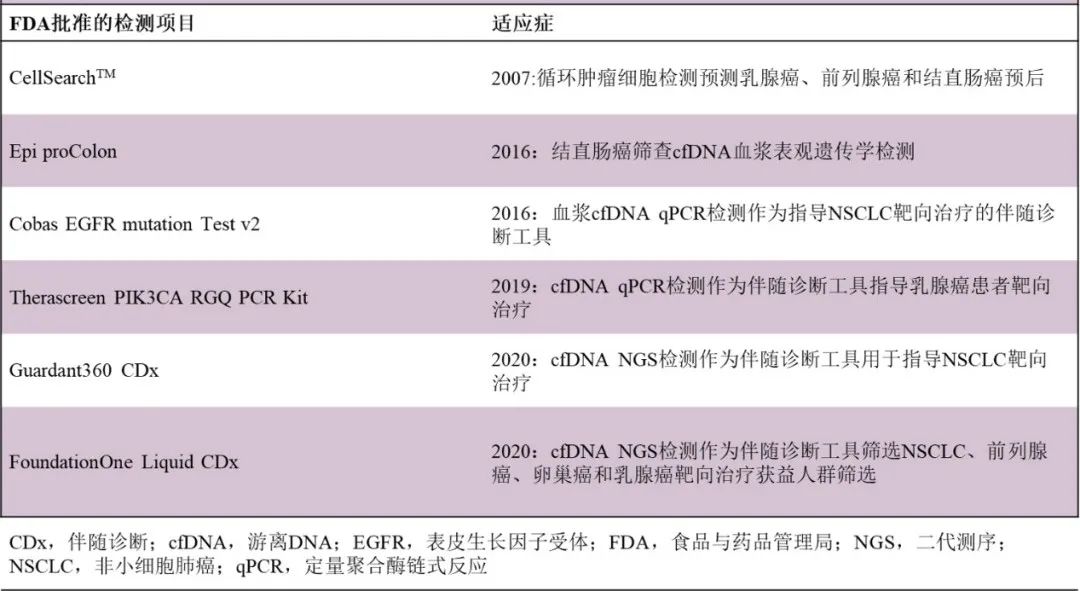
表5. 四种液体活检生物标志物的对比
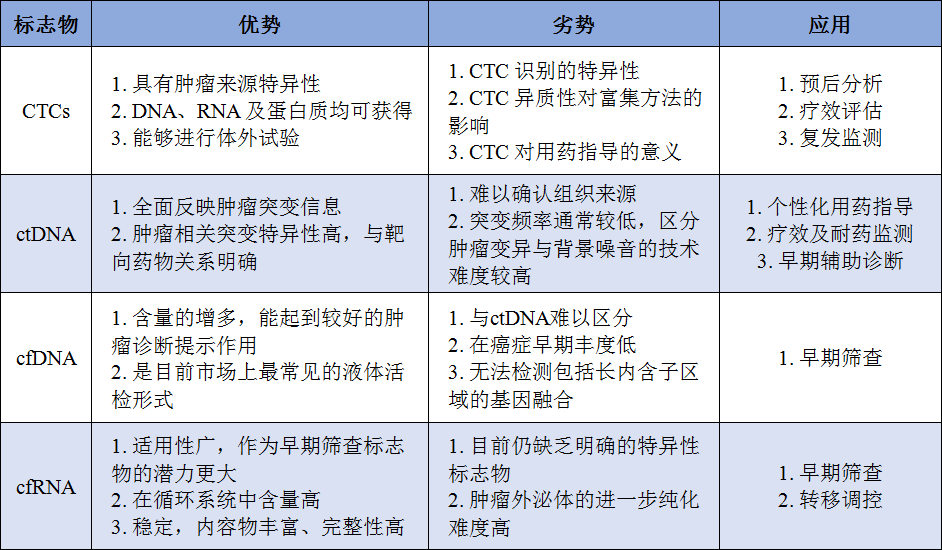
表6. 不同RNA测序技术的适用范围
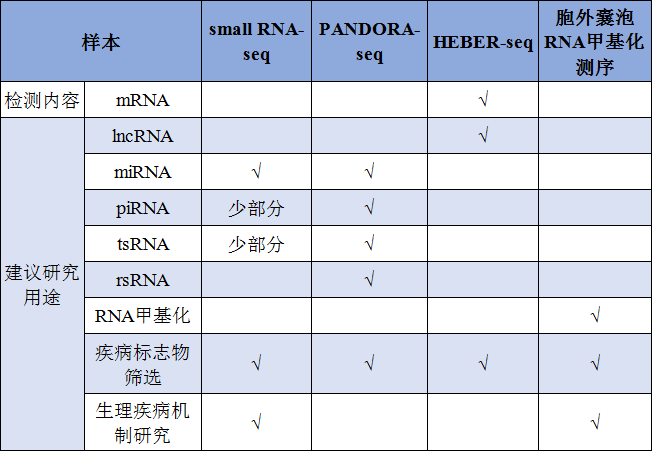
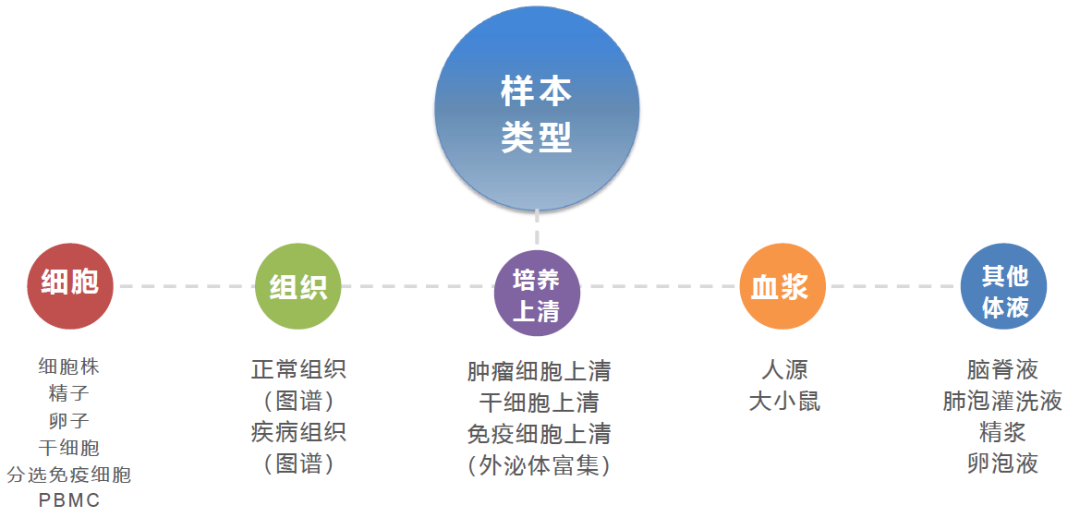
图3. 适合PANDORA-seq分析的样本类型
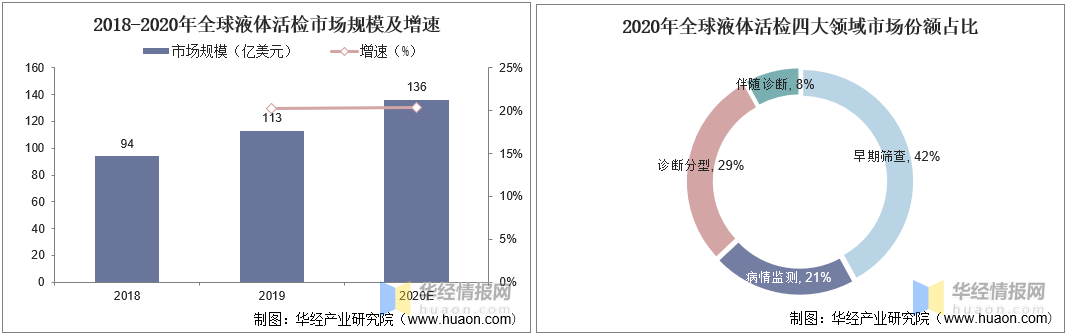
图4. 液体活检千亿蓝海市场(来源:华经产业研究院)
· 研究案例一 ·
Cell Discovery:精子sncRNA作为体外受精的精子质量评估标志物[6]

划重点
样本类型:接受体外受精治疗的患者精子样本
样本数量:87例(23例 VS 64例)
样本设置:高质量胚胎率组(H-GQE)VS 低质量胚胎率组(L-GQE)

在这项研究中,研究人员收集了87例接受体外受精治疗的患者精子样本,把优质胚胎率≥75%的列为高优质胚胎率组,有23例;优质胚胎率≤25%的列为低优质胚胎率组,有64例。
· 研究案例二 ·

划重点
样本类型:PBMC
样本数量:59例
样本设置:13例健康 vs 10例肺结核 vs 36例肺癌患者

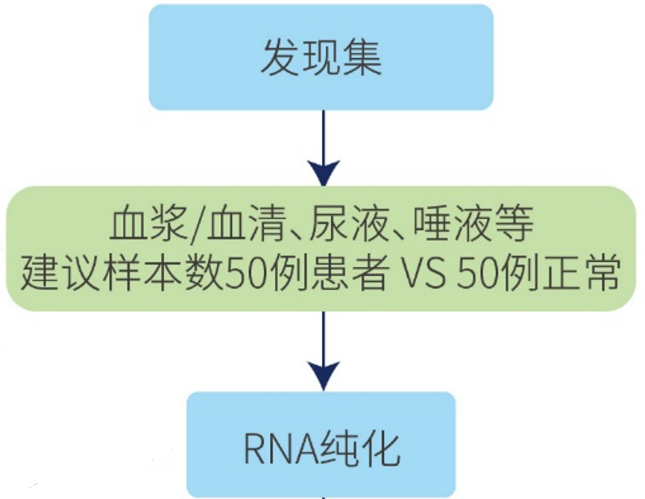
图5. 样本设置部分研究路径归纳
· 研究案例一 ·
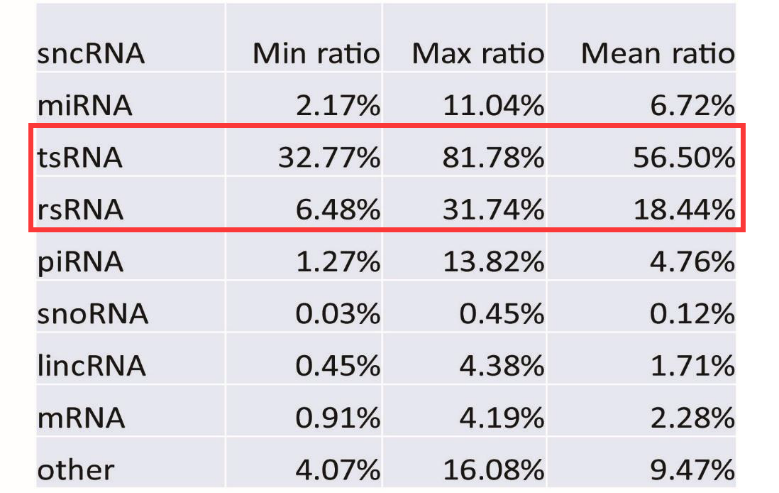
图6. 87例精子样本中各种sncRNA的比例,比例最高的是tsRNA和rsRNA
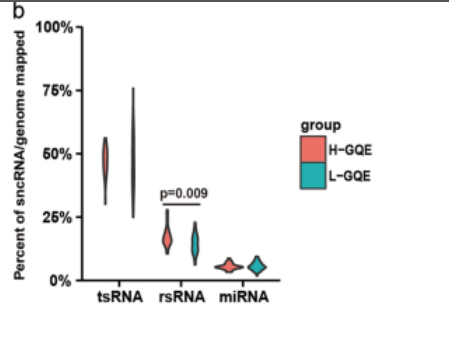
图7. 小RNA测序显示tsRNA的表达总量

图8. 两组(H-GQE和L-GQE)之间10个差异表达的tsRNA的热图
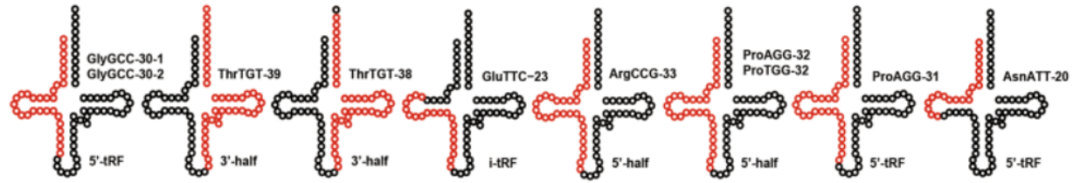
图9. 成熟tRNA序列中10个差异表达的tsRNA的示意图(tsRNA序列用红色标出)
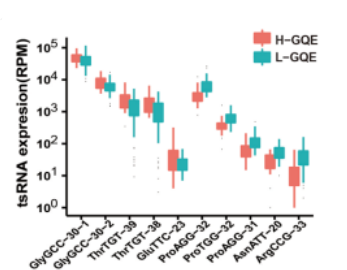
图10. 两组间10个差异表达tsRNA的条形图
该研究也检测了rsRNA作为标志物的潜力。为了探索rsRNA与精子质量之间的关联,研究者分析了rsRNA的表达并鉴定了28S-58(破折号后面的数字表示rsRNA的长度)等7种差异表达的rsRNA。实验数据表明,只有28S-58在低优质胚胎率组中表达上调,其余6个rsRNA都是下调。
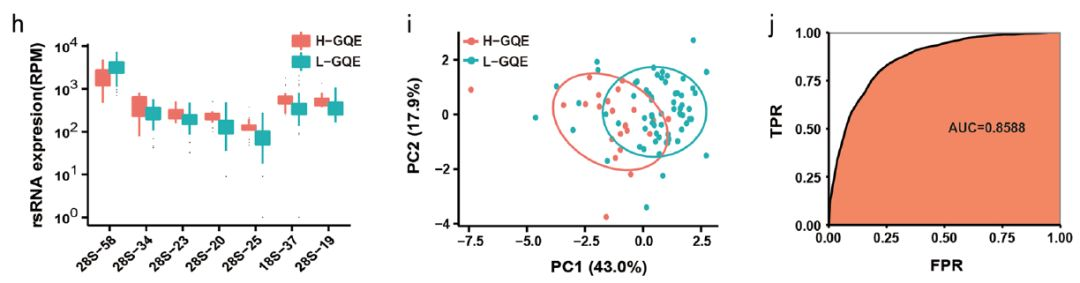
图11. 两组间差异表达的rsRNA,可能成为评估精子质量的生物标志物
通过这7种rsRNA也可以有效区分高优质胚胎率组和低优质胚胎率组,表明这些rsRNA具有与tsRNA相当的预测能力,可作为评估体外受精精子质量的潜在生物标志物。
· 研究案例二 ·
此研究检测了tsRNA在健康样本,肺结核样本以及肺癌患者样本中的差异表达情况,发现tsRNA-Ala等5种tsRNA在肺癌样本中表达上调。
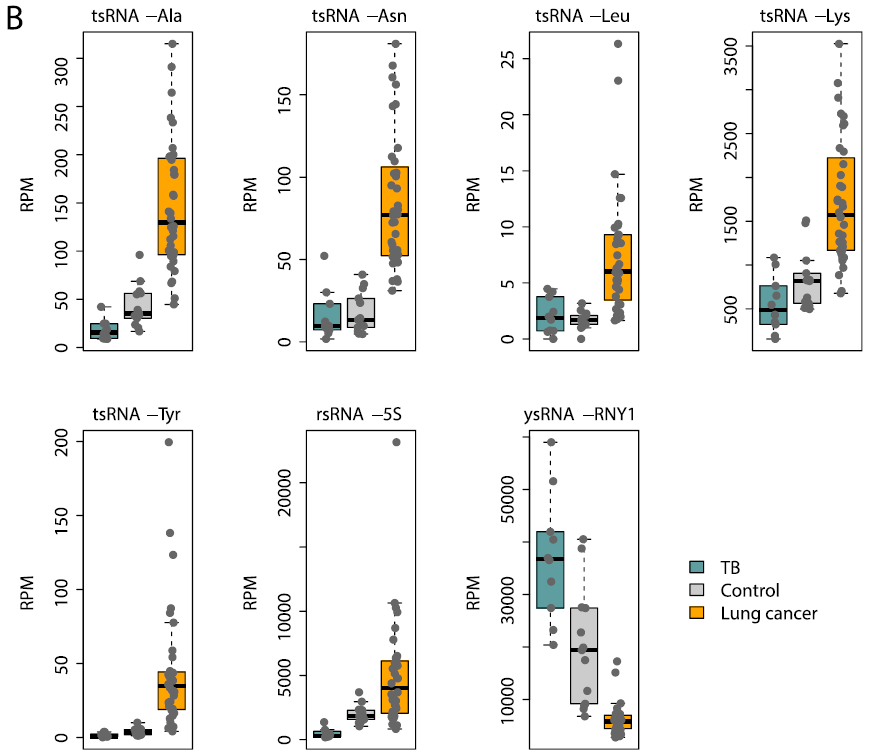
图12. tsRNA-Ala等6种tsRNA在对照组、肺癌和肺结核受试者(TB)中的表达谱。
图13. 潘多拉测序预测差异表达的分子标志物部分研究路径归纳
· 研究案例三 ·

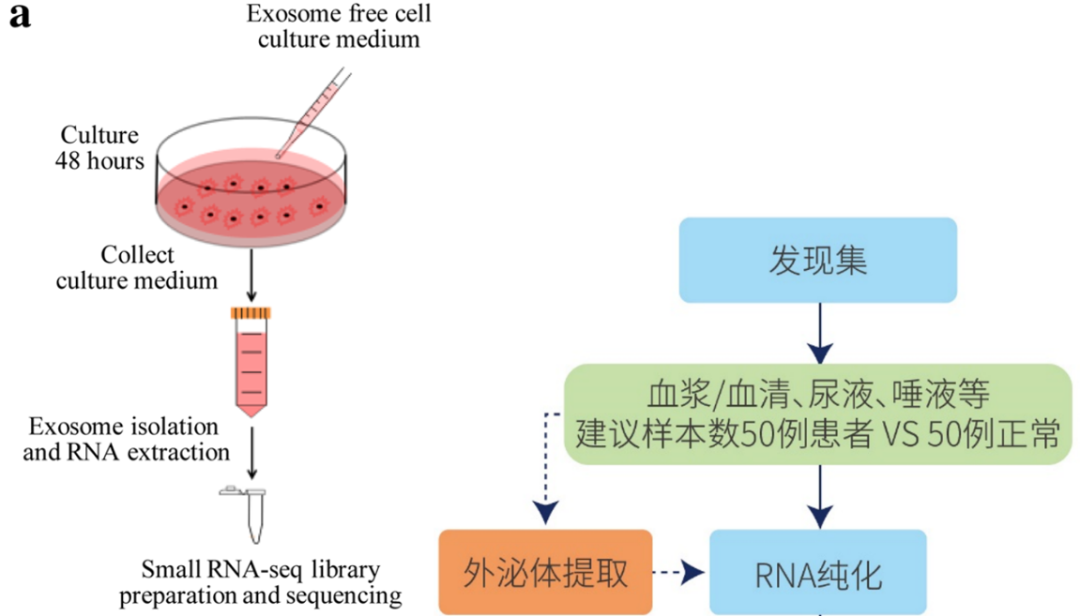
图14. 外泌体sncRNA疾病标志物研究,需要从血液/细胞培养基等样本中先提取出外泌体,再进行PANDORA-seq。
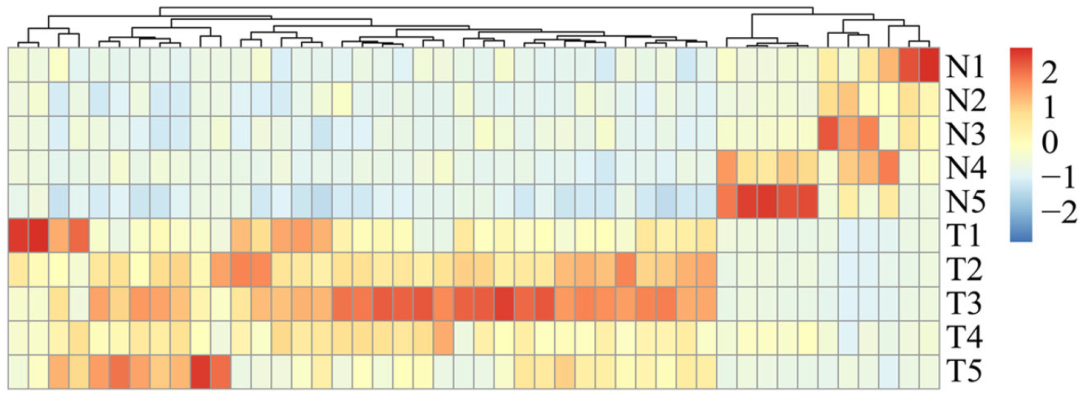
图15. 血浆外泌体tsRNA差异表达热图, 35种在肝癌患者中上调,11种下调
(N1-N5:5位健康人对照组;T1-T5:5位肝癌患者)
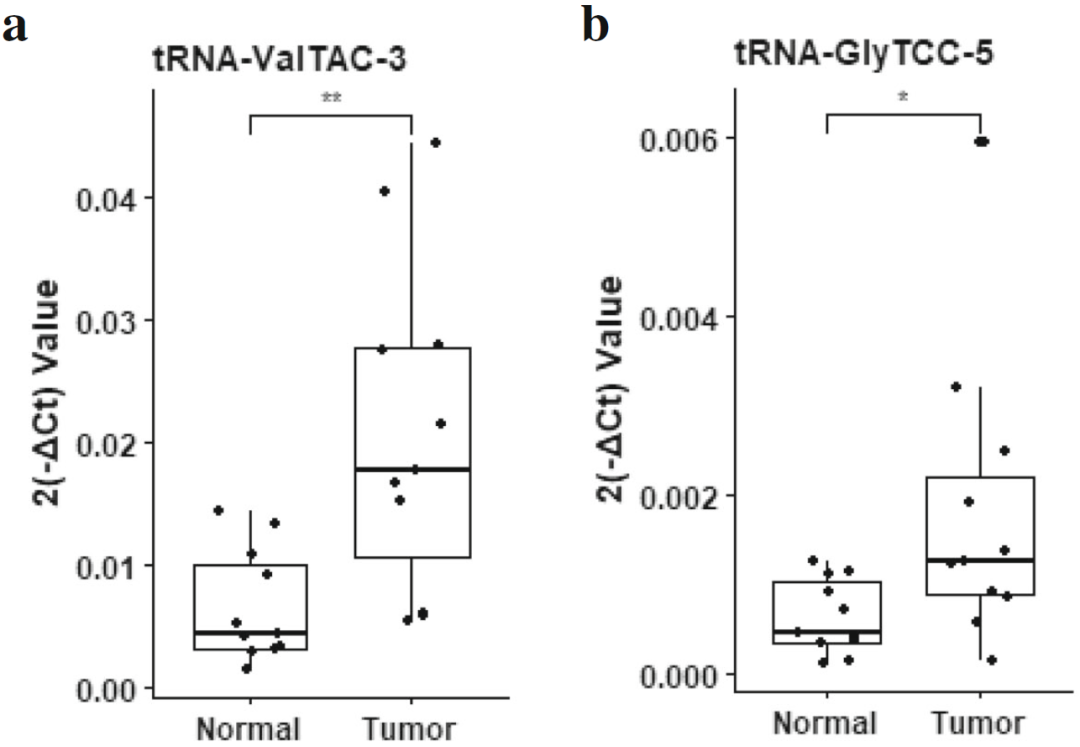
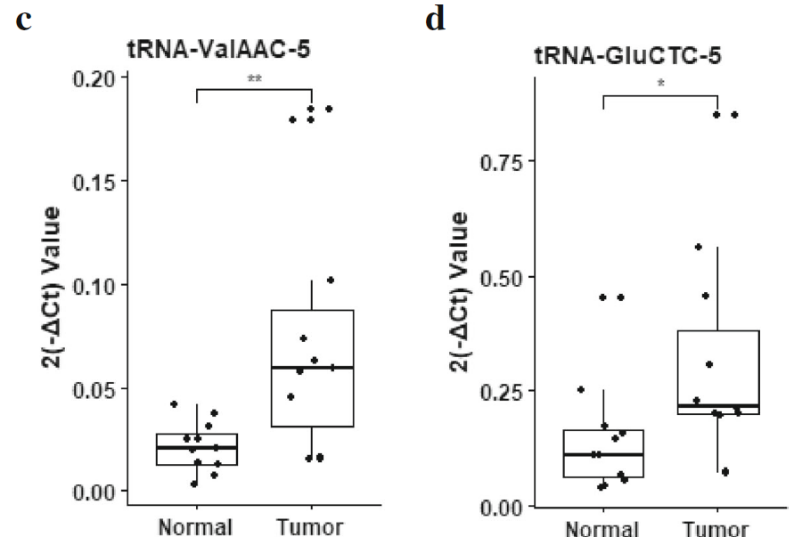
图16. RT-qPCR对显著差异表达的tsRNA进行鉴定
图17. RT-qPCR验证部分研究路径归纳
· 研究案例四 ·

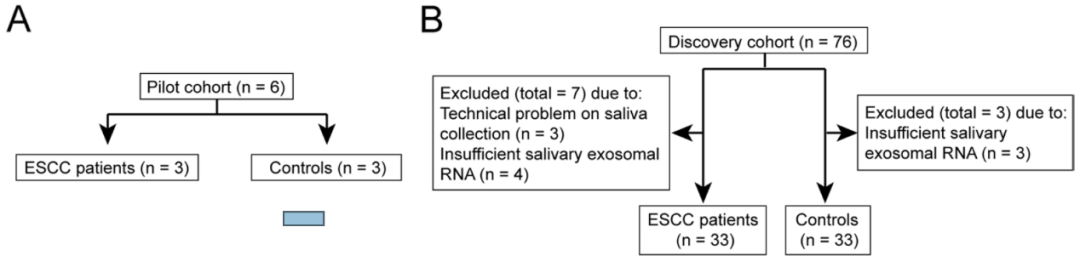
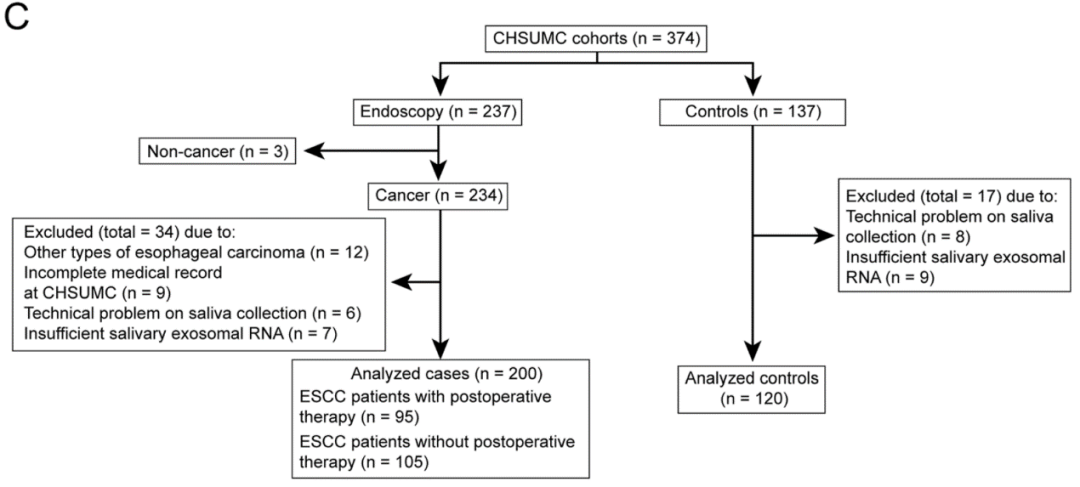
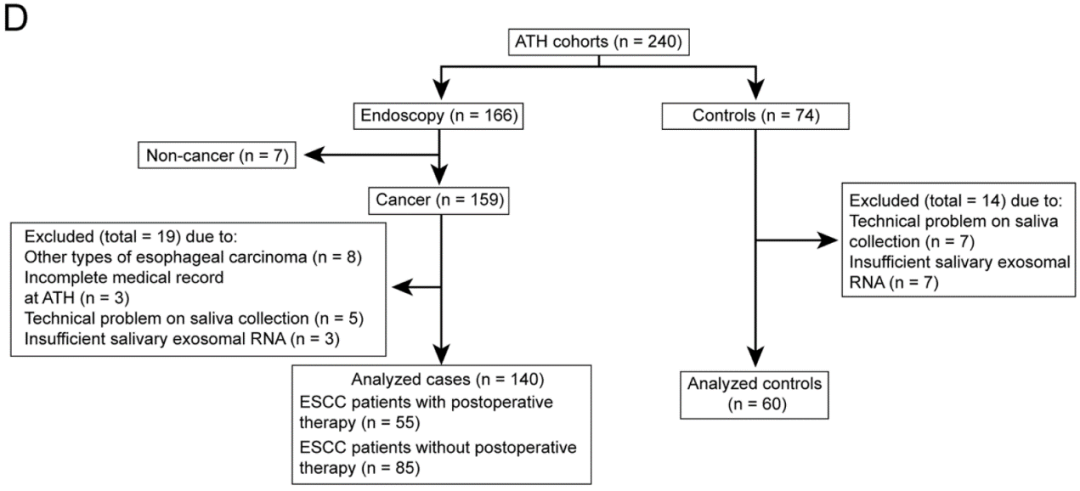
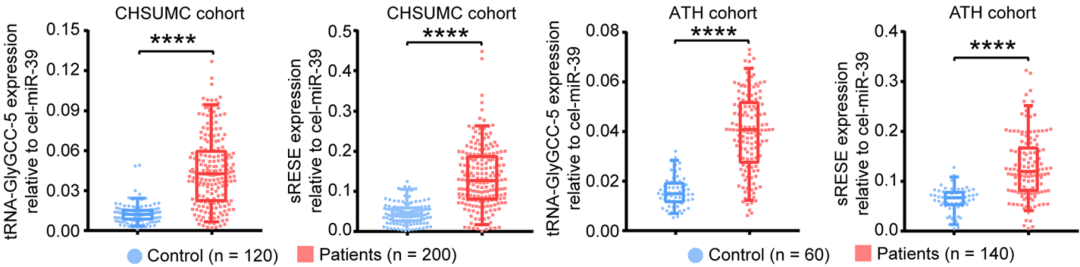
图18. 差异small RNA在训练队列和验证队列的验证
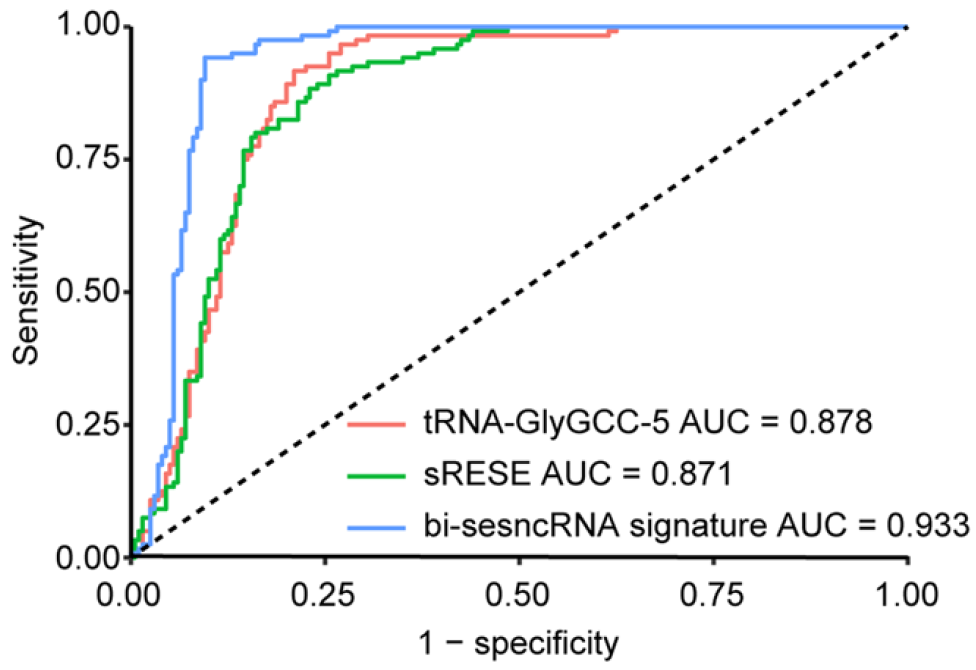
图19. 两个sncRNA在训练集的诊断效能
表7. 两个sncRNA以及联合使用在两个队列的诊断效能
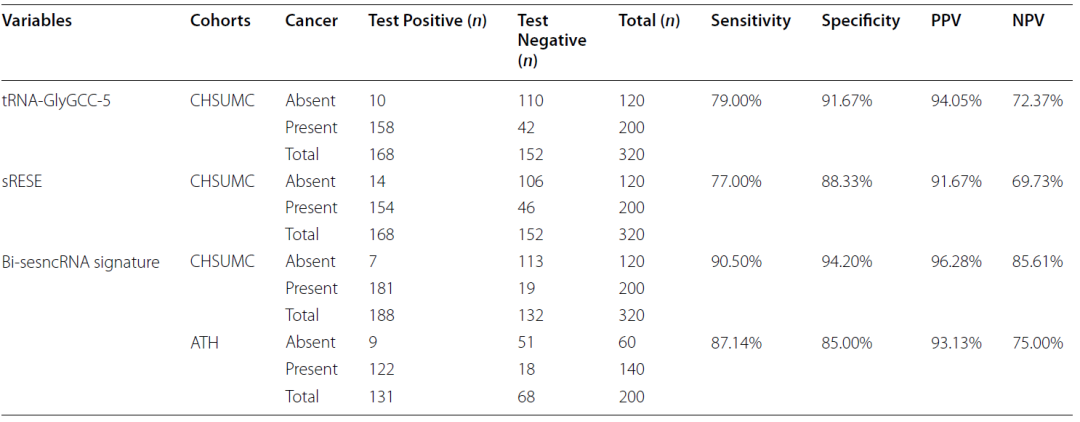
PPV:阳性预测值;NPV:阴性预测值
图20. 基于机器学习算法构建疾病诊断/预后评估模型部分研究路径归纳
写在最后
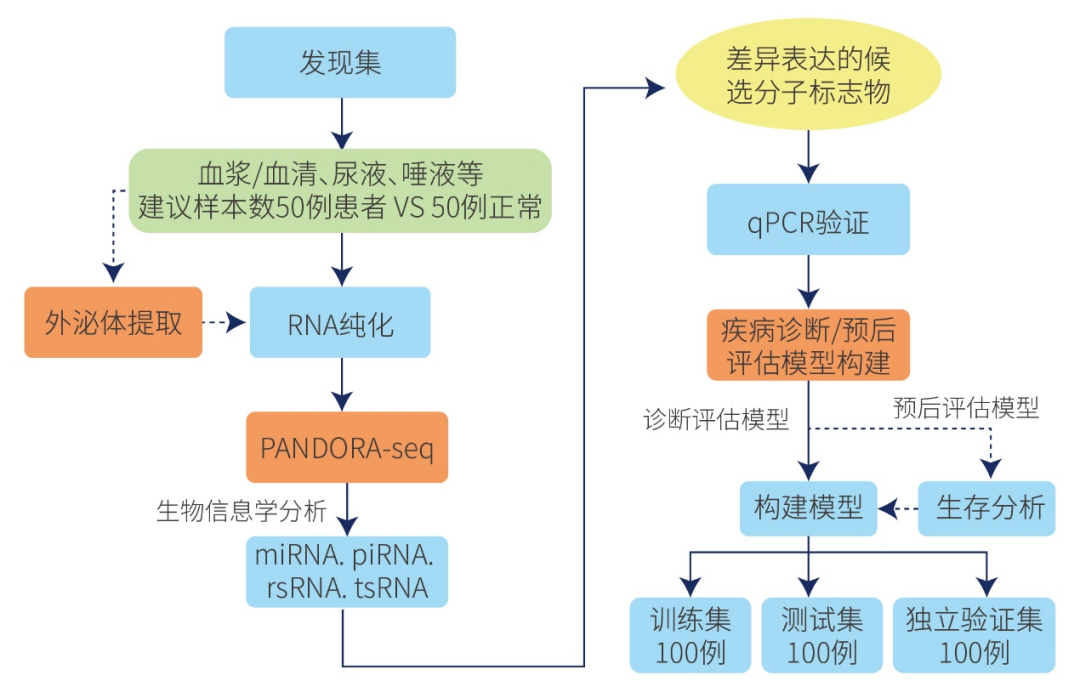
图21. PANDORA-seq进行非编码小RNA疾病标志物研究路径
参考文献
[1] 马剑峰,甘麦邻,朱砺等人. 转运RNA 衍生的小RNA 功能及其研究方法. 遗传[J]. 2021 年12 月, 43(12): 1107―1120
[2] 刘启鹏,安妮,岑山等人. piRNA 抑制基因转座的分子机制. 遗传[J] 2018 6 , 40(6): 445―450
[3] 许瑞雪,毛奕文,马洋洋等人. PIWI/piRNA在妇科恶性肿瘤中的研究进展. 海南医学2022年2月第33卷第3期
[4] Chu C, Yu L, Wu B, Ma L, et al. A sequence of 28S rRNA-derived small RNAs is enriched in mature sperm and various somatic tissues and possibly associates with inflammation. J Mol Cell Biol 2017 06 01;9(3)
[5] Shi J, Zhang Y, Tan D, et al. PANDORA-seq expands the repertoire of regulatory small RNAs by overcoming RNA modifications. Nat Cell Biol 2021 04;23(4).
[6] Hua M, Liu W, Chen Y, et al. Identification of small non-coding RNAs as sperm quality biomarkers for in vitro fertilization. Cell Discov. 2019 Apr 9;5:20.
[7] Gu W, Shi J, Liu H, et al. Peripheral blood non-canonical small non-coding RNAs as novel biomarkers in lung cancer. Mol Cancer. 2020 Nov 12;19(1):159.
[8] Zhu L, Li J, Gong Y, et al. Exosomal tRNA-derived small RNA as a promising biomarker for cancer diagnosis. Mol Cancer. 2019 Apr 2;18(1):74.
[9] Li K, Lin Y, Luo Y, et al. A signature of saliva-derived exosomal small RNAs as predicting biomarker for esophageal carcinoma: a multicenter prospective study. Mol Cancer. 2022;21(1):21. Published 2022 Jan 18.